Se presenta el caso de mujer de 78 años con antecedentes de Neumonía intersticial linfoide diagnosticada en abril de 2015, tras realizarse una biopsia pulmonar con aguja gruesa (BAG) guiada por TC a unos nódulos pulmonares que se habían detectado de forma incidental y donde se obtuvo la presencia de hiperplasia linfoide difusa, sin existencia de monoclonalidad.
Imagen 1 _ Imagen 2 _ Foto 1
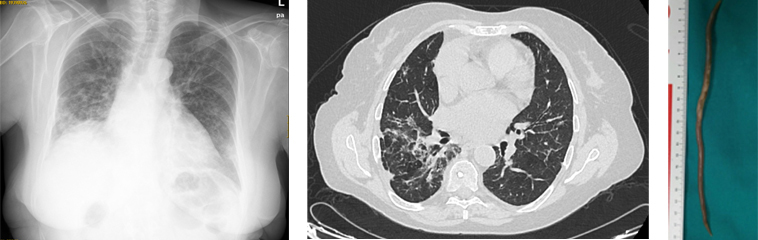
En el seguimiento posterior la paciente ha presentado algunas recaídas de su enfermedad pulmonar con aparición de infiltrados en la radiología de predominio en bases (Ver imagen 1 y 2), además de un empeoramiento clínico y funcional. En todas, la paciente tuvo una buena respuesta al aumento de la dosis de corticoide.
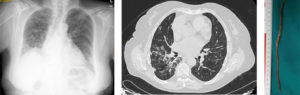
En julio de 2017 comienza de nuevo con empeoramiento de su situación y desde entonces presenta 3 ingresos hospitalarios con clínica de disnea de moderados esfuerzos, tos irritativa y fiebre además de unas pruebas de imagen con infiltrados pulmonares de características migratorias, ya que varían su localización apareciendo en ambas bases indistintamente. En todos los ingresos no presenta datos clínicos ni analíticos de infección y mejora con aumento de la dosis de corticoides. Ingresa de nuevo en marzo de 2018 como en otras ocasiones por fiebre sin claro foco, además de disnea y tos. En anamnesis dirigida refería únicamente pérdida de peso no cuantificada en los últimos meses. En las pruebas complementarias presentaba una analítica sin datos de infección y un rastreo microbiológico con diferentes cultivos (respiratorios, urinarios…) todos negativos. También presentaba una radiografía con un aumento de densidad redondeado en LID sin claro broncrograma aéreo. Con la sospecha de una nueva recaída de su enfermedad pulmonar de base se decidió aumentar dosis de Prednisona a 20mg/24h manteniendo cobertura antibiótica. Tras 4 días de ingreso con febrícula mantenida presenta de forma aguda sensación de cuerpo extraño a nivel faríngeo con tos intensa e importante disnea. Con la ayuda de sus dedos consigue la extracción de helminto de unos 22 cm que se envía a microbiología siendo catalogado de Ascaris lumbricoides (Ver Foto 1). Ante la situación descrita con el diagnóstico de síndrome de Loeffler se solicitó coprocultivo con determinación de parásitos donde se observaron formas adultas y huevos de Áscaris lumbricoides y se inició tratamiento con albendazol a dosis única de 400 mg. Tras el tratamiento se produjo la desaparición de la fiebre y la mejoría clínica de la paciente, se pudo bajar la dosis de prednisona a 10 mg diarios sin que la paciente presentara empeoramiento como en ocasiones previas. También presentó en analítica posterior eosinofilia que en ningún momento previo había aparecido y se realizó TAC toraco-abdominal donde a nivel pulmonar se observó un descenso importante de las lesiones intersticiales/exudativas de predominio en lóbulos inferiores (imagen 2).
Discusión: El síndrome de Löffler o Loeffler es una enfermedad en la cual los eosinofilos se acumulan en el tejido pulmonar en respuesta a una infestación parasitaria. Fue descrito en 1932 por Wilhelm Löffler, quien lo identificó en pacientes con neumonía eosinofílica causada por parásitos como Ascaris lumbricoides, Strongyloides stercoralis, Ancylostoma duodenale y Necator americanus.
Figura 1
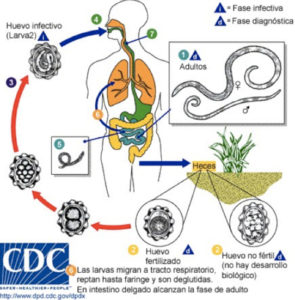
El ciclo de vida del Ascaris (Figura 1)
El hombre se infecta por el ascaris a través de la ingestión de sus huevos que se encuentran presentes en el suelo contaminado. Los gusanos adultos (1) viven en el lumen del intestino delgado. Una hembra puede llegar a producir aproximadamente 200.000 huevos al día, los cuales pasan a las heces (2). Es posible que se ingieran huevos no fertilizados, pero no son infectivos. Los huevos fértiles embrionan y se vuelven infectivos entre los 18 días y varias semanas después (3), dependiendo de las condiciones ambientales (óptimas: suelo húmedo, cálido y sombreado). Después de ser tragados los huevos infectivos (4), las larvas eclosionan (5), invaden la mucosa intestinal y son adquiridas por la circulación portal hacia la circulación sistémica, y luego a los pulmones. Las larvas maduran en los pulmones de 10 a 14 días (6), luego penetran a través de las paredes alveolares, y ascienden por el árbol bronquial hasta la faringe, donde son deglutidas (7). Una vez que han alcanzado el intestino delgado, siguen su desarrollo hasta gusanos adultos (8). Transcurren entre 2 y 3 meses desde la ingestión de los huevos infectivos hasta la puesta de huevos por la hembra adulta. Los gusanos adultos pueden vivir entre 1 y 2 años .
La infección sintomática aparece en general entre individuos con cargas de gusano relativamente altas. Con mayor frecuencia la etapa intestinal del gusano adulto (fase tardía) produce síntomas intestinales, hepatobiliares y pancreáticos; y la etapa de migración larvaria (fase temprana) produce manifestaciones pulmonares o síndrome de Loeffler. Éste aparece de 4 a 16 días después de la ingestión del huevo infeccioso. La migración de las larvas a través de los pulmones puede asociarse a síntomas respiratorios transitorios y neumonitis eosinofílica (tos seca, disnea, fiebre, sibilancias, malestar subesternal, etc).
Dentro de las pruebas de laboratorio, podemos observar eosinofilia periférica, que puede estar ausente en el periodo sintomático temprano; En cuanto a pruebas de imagen, se observa en radiografía de tórax infiltrados redondos u ovalados bilaterales, migratorios. En TC de tórax múltiples nódulos de predominio en periferia migratorios, o halo de atenuación en vidrio deslustrado. Por último el examen de heces no es útil para el diagnóstico de infección pulmonar, los huevos se detectan en heces al menos 40 días después de los síntomas pulmonares.
En nuestro caso sí fue útil porque se encontraba en fase tardía de la enfermedad. La fase tardía o intestinal aparece unas 6 a 8 semanas después de la ingestión del huevo. Obtenemos en pruebas de laboratorio eosinofilia periférica; en radiografía simple de abdomen se pueden observar grandes colecciones de gusanos.
El tratamiento en fase temprana, pulmonar o Síndrome de Loeffler son broncodilatadores, corticoides (tras descartar infección por Strongyloides para evitar síndrome de hiperinfección por Strongyloides), y no suele ser necesario tratamiento antihelmíntico. Ya en fase tardía o intestinal sí se administra terapia antihelmíntica como Benzimidazoles (albendazol o Mebendazol) u otros alternativos.
En nuestro caso probablemente la paciente presentó el síndrome de Loeffler con la aparición previa de tos, disnea e infiltrados radiológicos migratorios (cuando parecían agudizaciones de su enfermedad pulmonar de base) pasando posteriormente a presentar síntomas intestinales en fase tardía (molestias abdominales), llegando al diagnóstico en fase de gusano adulto. En cuanto a las pruebas de laboratorio, nuestra paciente no presentó en los meses previos al diagnóstico eosinofilia periférica, probablemente camuflada por tratamiento con corticoides.